Mesotelioma: fibre di amianto e il tumore
Le fibre di amianto causano il mesotelioma. È importante poter pensare di elaborare una terapia efficace di questa neoplasia. Infatti è fondamentale comprendere i meccanismi che causano il mesotelioma attraverso la trasformazione delle cellule pleuriche sane in cellule di mesotelioma (cellule mesoteliali).
Consulenza gratuita online mesotelioma
Mesotelioma pleurico: come ha origine il tumore
Le fibre di amianto esercitano la loro capacità di cancerogenesi essenzialmente attraverso tre principali meccanismi.
- Rottura dei cromosomi con azione meccanica che porta a un radicale stabile mutamento dell’ “assetto” genico delle cellule mesoteliali, per cui queste cellule finiscono con l’esprimere più geni che portano all’aumentata proliferazione e alla resistenza agli stimolo normalmente in grado di uccidere le cellule.
- Danno genetico dovuto allo stress ossidativo del ferro delle fibre di amianto. Questo tipo di danno ossidativo conduce ad una anormale espressione genica analogamente all’azione meccanica come quella precedente.
- Proliferazione delle cellule mesoteliali danneggiate che favorisce la selezione di cellule mesoteliali anormali, resistenti agli stimoli tossici e che rappresentano il primo passo verso la lor trasformazione in cellule tumorali.
La capacità delle fibre di asbesto di indurre fattori di crescita con l’attivazione di specifici segnali biochimici di resistenza alla necrosi ed all’apoptosi, che rappresentano un ulteriore, cruciale meccanismo di trasformazione neoplastica delle cellule mesoteliali.
Da queste considerazioni generali sui meccanismi di cancerogenesi è facile comprendere come la nostra attenzione si sia concentrata sui segnali biochimici considerati in grado di aumentare la resistenze delle cellule agli stimoli tossici. Così da favorirne, come evento, finale la comparsa di cellule neoplastiche attraverso lo stato di cellule trasformate dall’esposizione ad amianto.
Studio sul processo di cancerogenesi
La “trasformazione”, come stato intermedio che prelude, attraverso la progressiva acquisizione di resistenza alla morte cellulare, alla formazione di cellule tumorali indotte dall’esposizione all’ amianto. Quindi occorre concentrarsi sul rilascio dei fattori di crescita e l’attivazione dei relativi segnali biochimici come un meccanismo cruciale nella cancerogenesi del mesotelioma.
Nel 2001 si pubblicò sulla rivista Proceedings of National Academy of Science (PNAS) una serie di esperimenti che dimostravano come in un modello di co-cancerogenesi virus/amianto, le cellule mesoteliali e di mesotelioma producevano elevate quantità di fattore di crescita chiamato Hepatocyte Growth Factor (HGF), ben noto come in grado di contribuire alla sopravvivenza delle cellule esposte a stimoli tossici di varia natura.
A questo primo lavoro che apriva nuove prospettive verso lo studio dei segnali biochimici indotti dai fattori di crescita nella comparsa e progressione del mesotelioma pleurico. In particolare da alcuni anni proprio lo studio del segnale proliferativo si è progressivamente sviluppato. La nostra attenzione si è concentrata su segnali biochimici che vedono coinvolte alcune proteine, la cui attivazione gioca un ruolo essenziale nell’ aumentare la sopravvivenza delle cellule normali esposte ad agenti tossici e/o cancerogenetici.
Mesotelioma e attivazione di PI3K/AKT
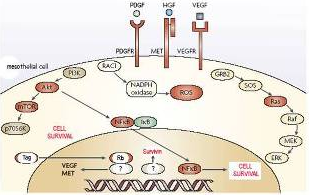
L’attivita di PI3K è ben nota come in grado di attivare una proteina definita AKT tra i quali principali effetti biologici viene considerata cruciale al capacità di conferire alle cellule maggiore resistenza agli stimoli tossici.
L’attivazione di questa proteina è significativamente legata all’azione di HGF così come di altri fattori di crescita come il Platelet Derived Growth Facor (PDGF) ed il Vascular Endothelial Growth Factor (VEGF), il cui rilascio da parte delle cellule di mesotelioma associata alla presenza dei rispettivi recettori sulle stesse cellule è stata ampiamente dimostrata.
Gli studi scientifici sul ruolo di AKT
La ricerca si è quindi concentrata sul ruolo di AKT sia nelle cellule mesoteliali coltivate sperimentalmente esposte ad amianto sia nelle cellule di mesotelioma. Sin dai primi esperimenti è risultato evidente come in effetti le fibre di amianto fossero in grado di indurre attivazione di AKT e come questa attivazione fosse significativamente responsabile del processo di trasformazione e resistenza alla tossicità esercitata dalle fibre.
Infatti l’utilizzo di inibitori sperimentali di AKT era in grado di indurre nuovamente tale tossicità. Quindi AKT è stata considerata una proteina chiave nel processo che porta alla selezione di cellule mesoteliali tumorali dopo esposizione a fibre di amianto. Il passo successivo è stato quello di identificare un metodo potenzialmente applicabile nella pratica clinica che fosse in grado di indurre lo stesso effetto inibitorio di AKT nelle cellule di mesotelioma.
L’attenzione si è quindi nuovamente concentrata sui fattori di crescita in grado di attivare AKT e sull’identificazione di specifici inibitori del loro effetto su questa proteina. In particolare l’intensa espressione del recettore per PDGF (PDGFr) sulle cellule di mesotelioma ha suggerito l’utilizzo di uno specifico inibitore degli effetti biologici indotti dall’interazione tra PDGF e PDGFr.
Il mesotelioma e l'uso del farmaco Imatinib
La disponibilità sul mercato sul mercato un farmaco (il cui principio attivo è Imatinib Mesilato, nome commerciale, Gleevec®), in grado di interferire con il legame PDGF/PDGFR ha quindi indotto la ricerca ad testare quale effetto l’Imatinib fosse in grado di esercitare sull’attivazione di AKT. Si è così dimostrato come Imatinib Mesilato sia in grado di indurre selettiva inibizione dell’attivazione di AKT ed anche un assai significativo aumento della sensibilità ad alcuni farmaci chemioterapici come la Gemcitabina.
Questo insieme di dati in vitro ha quindi giustificato l’utilizzo del’associazione Gemcitabina/Imatinib anche su animali da esperimento cui era stato sperimentalmente indotto un mesotelioma umano. Il trattamento di questi tumori sperimentali ha indotto un significativo miglioramento della sopravvivenza degli animali testati con una riduzione o stabilità delle dimensioni del tumore. La logica conclusione di questi studi preclinici è stata quella di indurre il mondo scientifico e il nostro gruppo a valutare la concreta possibilità che questi risultati potessero e dovessero essere testati anche sui pazienti con mesotelioma.
Inizialmente sono stati trattati pazienti con malattia assai estesa e refrattari a ogni precedente terapia nel’ambito di una somministrazione definita “compassionevole”. La capacità del trattamento di indurre risposte assai significative sia in termini di riduzione della massa tumorale che di miglioramento della qualità di vita nonché la percezione che questi effetti si ripercuotessero anche su una più lunga sopravvivenza, ha infine indotto di iniziare un’ ulteriore sperimentazione clinica su pazienti selezionati tra quelli con una mancata risposta alla chemioterapia o ripresa di malattia dopo una prima risposta alla chemioterapia.

Altri metodi di inibizione delle proteine
Altri studi finalizzati all'inibizione di altre proteine responsabili della sopravvivenza e progressiva trasformazione delle cellule mesoteliali sono state identificate. Lo stesso metodo sperimentale utilizzato per AKT è stato utilizzato, ad esempio, per un altra proteina denominata Nuclear Factor KB (NFKB), la cui attivazione nelle cellule mesoteliali da parte delle fibre di asbesto e la spontanea attivazione in quelle di mesotelioma induce un’aumentata resistenza a stimoli tossici di vario tipo.
L’inibizione della sua attività sia con un inibitore sperimentale utilizzato su colture cellulari di mesotelioma e successivamente con farmaco specifico il cui principio attivo è Bortezomib (Velcade®) hanno dimostrato un’intensa attività citotossica in vitro e antitumorale in animali cui era stato indotto sperimentalmente il mesotelioma. Quindi, analogamente a quanto avvenuto per gli inbitori di AKT e Imatinib, anche Bortezomib è stato testato in un protocollo sperimentale a livello europeo per i pazienti con mesotelioma chemio reresistente o recidivato dopo la prima chemioterapia. I risultati sono attualmente in fase di pubblicazione e mostrano una significativa efficacia anche di questo trattamento.
Mesotelioma e terapia transazionale
Questo insieme di dati sperimentali rappresentano un eccitante modello di ricerca e terapia transazionale (dal laboratorio alla sperimentazione clinica) che nel mondo sta diventando l’approccio che sta cambiando tutto il nostro modo di studiare e curare le malattie ed in particolare il cancro.
La ricerca preclinica e clinica non consentono ancora di giungere alla definizione di nuove standardizzate terapie per il mesotelioma ma i risultati ottenuti negli ultimi anni certo rappresentano ben più di un indizio che lo studio estensivo dei meccanismi molecolari cambierà la prognosi di questa neoplasia tristemente nota come essere assai aggressiva e resistente ai trattamenti chirurgici, radio e chemio terapici.
Rovesciando frasi prese in prestito diremmo “ottimismo della ragione”, non illusioni ma dati oggettivi che dimostrano che anche per questo cancro i passi avanti ci sono già stati e siamo in una nuova era del suo trattamento. Riteniamo però opportuno chiudere con un invito che ci deriva da altri dati sperimentali.

Mesotelioma ed esposizione ad amianto
L’amianto è stato largamente utilizzato nel nostro Paese per decenni. La tragica storia esemplare dell’amianto è corsa spedita nel nostro Paese fino al 1994, trenta anni dopo la prova provata della sua pericolosità.
Se sono stati necessari 30 anni percorrere ai ripari nei confronti delle esposizioni lavorative quanti ne saranno necessari perché il legislatore consideri tutte le esposizioni (anche quelle minime e apparentemente occulte) come in grado di indurre neoplasie pleuropolmonari? Eppure le evidenze scientifiche in questo senso sono sempre più numerose ed inquietanti. Non solo nei laboratori dove è evidente in modelli di cancerogenesi la pericolosità di basse concentrazioni di amianto per trasformare le cellule mesoteliali (le alte concentrazioni uccidono invece tutte le cellule senza trasformarle) ma anche casistica di pazienti ammalatisi di mesotelioma per esposizione minima più o meno prolungata.
La ricerca deve curare le malattie e il mesotelioma in particolare, ma anche indicare alle istituzioni come recepire le evidenze scientifiche per prevenire una lotta ancora difficile e dolorosa.
Nuove terapie per il mesotelioma: immunoterapia
L'immunoterapia è uno degli approcci terapeutici per il mesotelioma, in particolare quello pleurico e peritoneale. Rispetto alla chemioterapia, l’immunoterapia utilizza le cellule immunitarie naturali per combattere il cancro. Di conseguenza ha effetti collaterali più lievi (eruzione cutanea, tosse o problemi intestinali).
I farmaci immunoterapici sono inibitori dei checkpoint, come ad esempio il pembrolizumab. Vanno somministrati per via endovenosa ed influenzano le cellule immunitarie in modo da identificare e distruggere le cellule tumorali, impedendone altresì la recidiva. Tra gli studi sull’immunoterapia in realzione al mesotelioma pleurico in fase metastatica non precedentemente trattato ricordiamo anche il CheckMate-743.
A tal proposito, il Dott. Montilla, membro del Comitato tecnico-scientifico dell'ONA, illustra gli aspetti dell'immunoterapia come nuovo approccio per il trattamento di neoplasie durante l'incontro del 16.01.2023.
Home >> Dipartimenti >> Mesotelioma >> Cos'è il mesotelioma






